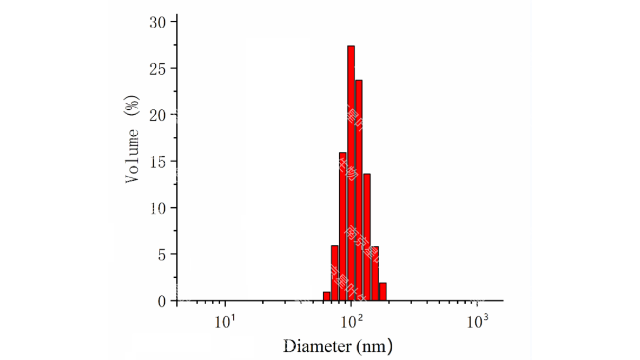
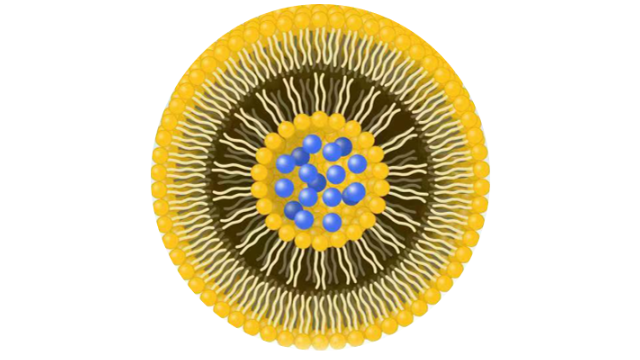
固体脂质纳米颗粒和纳米结构脂质载体虽然脂质体作为药物载体是有用的,但它们需要使用有机溶剂的复杂生产方法,在包裹药物方面表现出低效率,并且难以大规模执行。固体脂质纳米颗粒(SLN)和纳米结构脂质载体(NLC)的开发是为了解决这些缺点。传统的脂质体由液晶脂质双层组成,而SLN由固体脂质组成,和NLC由固体和液晶脂质混合物组成。SLN和NLC的粒径在40~1000nm之间。SLN和NLC表现出增强的物理稳定性,解决了脂质体基础配方的主要限制之一。SLN和NLC还具有更高的装载能力和更高的生物利用度,不需要使用有机溶剂就可以大规模生产,并且比其他LNPs更稳定。此外,分子在固体状态下迁移率的降低使得SLN和NLC能够更精确地控制其药物有效载荷的释放。然而,在长期储存中,SLN的结晶可以将掺入的药物排出到周围介质中脂质体是由多种组分构成的,主要包括:磷脂质、胆固醇、表面活性剂和PEG2000等。肝脏靶向脂质体载药注射
脂质体的Zeta电位Zeta电位被认为是影响细胞摄取和药物传递的重要因素之一。与带电系统相比,膜紧密包裹的中性电荷脂质体往往在循环中停留更长时间,并表现出更高的药物保留率。某些血浆蛋白对脂质体具有亲和力如果脂质体带电,这种亲和力就会增强。特别是阳离子系统有望迅速与体循环中的各种成分相互作用,从而在体内具有更短的半衰期。众所周知,阴离子脂体含有带负电荷的脂质,如磷脂酰丝氨酸(PS)、磷脂酰二酸(PA)和磷脂酰甘油(PG),会被巨噬细胞吸收,从而在短时间内从循环中消失。河南脂质体载药定做含有DOTAP、胆固醇和DSPC-PEG2000的阳离子脂质体可以递送microRNA 。

由于阿⽶卡星在⼄醇中的溶解度有限,在使⽤⼄醇输注制备脂质体过程中,阿⽶卡星转移到半可溶性的凝聚状态,被包裹在脂质体的核⼼内部。令⼈惊讶的是,获得了较⾼的包封效率(在优化的制备参数下,游离药物为5.2%)和药脂⽐(~0.7)。由于其多阳离⼦性质,被包封的药物在脂质体膜上表现出低通透性,使脂质体在⾎液循环过程中保持稳定。阿糖胞苷(DepoCyte)、**(DepoDur)和布⽐卡因(Exparel)⽔溶液被包裹在MVLs 的腔室中(由94%的⽔腔和4%的脂质组成);因此,⼩体积的脂质体悬浮液中含有⼤量药物。为了进⼀步提⾼包封效率和缓释,可采⽤将药物化合物从单质⼦⽆机酸盐转化为⼆质⼦或三质⼦⽆机酸盐(如硫酸盐盐或磷酸盐)和多醇有机酸共包封的⽅法。
脂质体中的点击反应**近,利用巯基炔“点击”化学筛选了一种仿生硫醚脂质文库,该文库将阳离子硫醚胺脂质与两种疏水烷基硫醇偶联。一种含有DOPE的脂质制剂被发现可以增加各种细胞类型中GFP特异性siRNA的摄取。由于阳离子脂质体通常表现出相对较高的细胞毒性,因此人们提出了各种策略来降低其毒性并增强其在体内对siRNA的递送。为此,研究人员将无毒且可生物降解的阴离子聚合物包覆在阳离子脂质体上,如聚l-谷氨酸钠盐、聚(丙烯酸)钠盐、葡聚糖硫酸钠盐、海藻酸钠盐、透明质酸钠盐、硫酸肝素钠盐和羧甲基纤维素钠盐。在这些阴离子聚合物中,聚谷氨酸在大范围内没有任何明显的毒性,并且与未包被的脂质体相比,包被的阳离子脂质体在肝脏和肺组织中的siRNA递送增强。LNP载体是核酸类药物的成功载体之一。
载药脂质体引入荧光的作用将荧光标记引入载药脂质体有几个潜在的作用:1.荧光标记的定位和跟踪:通过将荧光标记引入载药脂质体,可以追踪脂质体的位置和运动,从而了解载药脂质体在体内的分布和代谢情况。这对于药物输送系统的研究和优化至关重要。2.药物释放的实时监测:荧光标记可以作为一个指示剂,帮助研究人员实时监测载药脂质体中药物的释放过程。这对于了解载药脂质体的释放动力学以及优化药物释放速率至关重要。3.增强成像性能:通过引入荧光标记,可以使载药脂质体在成像技术(如荧光显微镜、近红外成像等)中更容易被检测到,从而提高成像的灵敏度和准确性。这对于药物输送系统的可视化和定量分析非常重要。4.生物学研究的工具:荧光标记的载药脂质体还可以作为生物学研究的工具,在细胞学和生物医学研究中广泛应用。它们可以用于细胞标记、细胞跟踪、细胞成像等领域,为生物学研究提供了便利。脂质体疫苗可以机器体内的免疫应答。河南脂质体载药定做
由于AS-ODNs可以下调某些RNA并抑制靶蛋白的表达,因此它们被认为具有作为核酸药物的潜力。肝脏靶向脂质体载药注射
siRNA脂质体
RNA干扰(RNAi)途径允许siRNA和miRNAs负向调节蛋白表达。siRNA是21~23对核苷酸组成的双链RNA,可诱导同源靶mRNA沉默。为了发挥作用,双链siRNA分裂成两个单链RNA:乘客链和引导链。乘客链被argonaute-2蛋白降解,而引导链则被纳入RNAi诱导的沉默复合体中,该复合体结合与引导链互补的mRNA并将其切割。siRNA似乎具有***多种疾病的巨大潜力,因为它们可以很容易地下调各种靶mRNA,而不考虑它们的位置(即在细胞核或细胞质中),并且它们的特异性结合表明它们比传统化学药物诱导的副作用更少。作为一种新型的基于核酸的***策略,siRNA***与传统的化学药物相比具有许多优势。然而,为了促进基于siRNA的***方法的发展,必须克服一些挑战,包括需要识别适当的靶基因和开发优化的递送系统。许多研究人员试图利用阳离子脂质体提高siRNA的细胞递送和基因沉默效率。例如,由DC-6-14、DOPE和胆固醇组成的阳离子脂质体被用于递送萤火虫荧光素酶特异性的siRNA。当阳离子脂质体与siRNA持续剧烈搅拌混合时,转染效率提高,说明将siRNA加载到阳离子脂质体上的方法可以调节转染效率。siRNA脂丛的***应用因靶蛋白而异。 肝脏靶向脂质体载药注射