药物安全性评价的地位和价值体现在以下三个方面:1.在支持新药临床研究时,并不需要在进入临床研究(I期)前完成所有相关研究,而是分阶段来分别支持I、Ⅱ、Ⅲ期临床研究,为如何进行临床研究提供重要参考,具体体现在临床研究方案中的给药剂量(尤其是I期临床研究的起始剂量)、安全性检查/监测指标和检测时机的确定,危险性的预测和救治措施的实施等方面;2.在临床研究过程中,甚至上市后,出现非预期重要的安全性问题且难以判断/预测其风险性等情况下,需再次进行有关的非临床安全性研究(包括机制研究),通过临床研究信息为非临床安全性研究提供方向和目标,以减少临床研究和(或)临床应用的风险;3.在临床研究完成后,受试药的临床有效性和安全性已有一个基本结论,此时药物安全性评价的某些结果(如致*性等)可能是比较终确定受试药是否批准上市(利弊权衡)的重要依据之一。药物安全性评价中的急性毒性试验,就找英瀚斯。广东专业药物安全性评价公司

在推进药物安全性评价方面,推出了人用药配药新监管措施和保障药品供应链的规定,为继续加速药品审评的速度和效率,也推出了功能强大的新工具以加速“突破药物”的研发和审评,加快药品或生物制品的研发,必须有突破性认证、优先审评和/或快速通道状态结合的加速审评系统的支持。在医疗器械方面,基于风险的机制,为确保患者安全,建立***器械识别码用以提高医疗器械的可追踪性和安全性,必须保证供应商能够用安全、准确、可靠的测试结果,继续推动诊断测试、指导***决策服务。浙江专业药物安全性评价药物安全性评价结果直接影响临床试验审批。
世界监管科学促进创新药发展举措收到实效:(1)通过新药评审沟通活动,促进药物开发;(2)促进在药物开发过程中与临床试验发起人交流;(3)促进生物标志物与药物基因组学应用,促进以患者报告和其他重点评价工具开发;(4)促进罕见病药物开发;(5)在新药审评中使用风险效益评价工具;(6)以患者为中心的药物开发项目,召开相关会议公布总结报告;(7)药品安全体系现代化,评价风险评估与减低策略(REMS)的实施效果,促进REMS标准化以进一步融入医疗保健体系;(8)通过主动监测体系开展药物安全性评价,促进药物警戒现代化;(9)提交eCTD文件提高效率,提高药品审评效率;(10)加速新药审评,促进新药和原创性生物大分子药审评透明度与沟通交流项目,以促进创新药审评审批。
药品安全评价特指为了评价药品安全性,在实验室条件下用实验系统进行的非临床安全性评价试验。药品安全评价是为了评价药品安全性,在实验室条件下用实验系统进行的试验,包括安全药理学试验、单次给药毒性试验、重复给药毒性试验、生殖毒性试验、遗传毒性试验、致*性试验、局部毒性试验、免疫原性试验、依赖性试验、毒代动力学试验以及与评价药品安全性有关的其他试验。规范药品安全评价相关检验检测工作,依据《药品检验机构资质认定条件与检验规范》、《药物非临床研究质量管理规范》(GLP)及相关法律法规文件、国家标准,制定本规范。新药从研制过渡到临床,必须进行临床前的药物安全性毒理学评价。
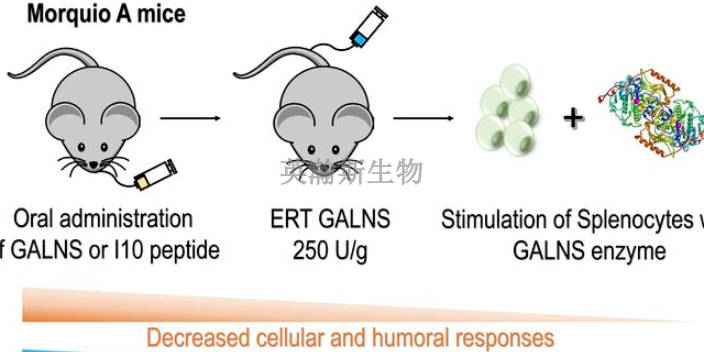
药物安全性评价,药学研究的风险控制与阶段性要求创新药的药学研究主要是为了满足不同阶段临床试验需要,IND阶段药学研究应首先能进行药物安全性评价。目前,一般认为,对于创新药可能引起临床安全性的主要风险包括:产品未知或不纯组分、化学结构含有或潜在毒性成分、稳定性差、杂质未充分确定等[]。这其中涉及单抗产品的主要风险为,细胞库未充分检定、动物源性成分生物安全性风险、生产工艺不稳定造成生物活性改变等。因此,药学研究若存在上述(不限于)影响临床用药安全性的重大缺陷,申请人必须在开展临床试验前予以解决。新药上市前,药物安全性评价必须经过严格的审核和验证。山东推荐的药物安全性评价检测
英瀚斯药物安全性评价,特殊毒性试验:溶血、过敏、刺激性试验等。广东专业药物安全性评价公司
全新序列抗体药物(改良单抗或新靶点单抗)自2013年**免疫疗法位列年度“科学**突破”**后,以PD-1/L1为**的免疫检查点蛋白已经成为抗**抗体开发的新靶点。在保证药物安全性评价的前提下,目前国际上已经有两个抗PD-1单抗(nivolumab,pembrolizumab)和3个抗PD-L1单抗(atezolizumab,avelumab,durvalumab)上市。目前早期的抗PD-1/L1单抗多使用无效应功能的IgG4(S228P)或IgG1(N297A)恒定区。后期开发的抗PD-L1抗体出于作用机制的考虑采用具备效应功能的IgG1亚型。在国内,也有至少10个抗PD-1/L1单抗注册临床。广东专业药物安全性评价公司