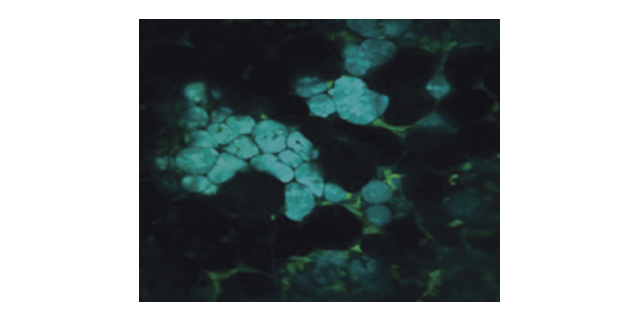
共聚焦显微可以呈现这么漂亮的图像,是不是什么样品都可以用共聚焦显微镜拍拍拍.....得到各种各样清晰漂亮的图像呢?答案是否定的,任何事物都有优缺点,何况一台仪器呢,共聚焦显微镜也是有自己的局限,共聚焦有哪些局限呢:1.共聚焦显微镜只能拍摄约200um以内的的样品,对于厚的或者样品不能进拍摄;2. 共聚焦显微镜由于是逐点进行扫描,对样品的光毒性还是比较大的,特别是拍摄活细胞样品时就更容易对样品进行淬灭;3. 由于光照射的区域几乎能通过这个Z轴的层面,所以对于空间定点光刺激的实验定点位置就不是特别精确;并且激光共聚焦显微镜没有纯紫外进行激发,对于一些特殊激发波长的实验,效率非常低。双光子显微镜使用长波长脉冲光,是通过物镜汇聚的。美国2PPLUS双光子显微镜成像视野
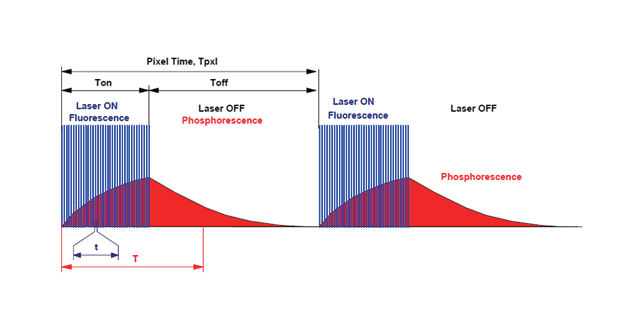
由于具有较高输出功率的光源可以提高成像速度,在我们的实验中,时间分辨率主要是受OPO输出可见光激光功率的限制。尽管在单点扫描系统中,v2PE激发会使得空间分辨率提高,但多聚焦v2PE显微镜具有与1PE多聚焦显微镜近乎相同的横向分辨率,这主要是多聚焦成像和单点扫描技术之间的差异造成的。由于v2PE的激发体积小于1PE,引入图像扫描技术可以进一步提高空间分辨率,这种技术需要通过在阵列前引入额外的微透镜阵列来实现。除此之外,由于可见光区域的共振效应,可能会产生光漂白,因而为了延长观察时间,系统还需要对激发强度和曝光时间做进一步优化。进口布鲁克双光子显微镜荧光寿命计数双光子显微镜大量运营在实验室当中。

高光子密度带来的高能量容易损伤细胞,所以双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,其脉冲达到最大值所持续的周期只有十万亿分之一秒,而其频率可以达到80至100兆赫,这样即能达到双光子激发的高光子密度要求,又能不损伤细胞,使扫描能更好地进行。双光子显微镜在各领域研究中已有许多成功实例生物领域:贝尔实验室的Svoboda等人研究了大脑皮层神经元细胞内钙离子动力学情形。利用双光子显微镜观察到的现象证明了钙离子的增加依赖于肌体触发的钠离子作用电势。信息领域:美国科学家Rentzepis提出了一种在现有二维光盘的基础上将数据储存扩展到三维空间。由于双光子激发具有作用精细体积小的特点,避免了层与层之间的互相干扰,极大地提高了数据储存密度。
对生物样品的三维观测是了解细胞功能的重要方法之一。目前已有的三维荧光成像技术包括光片显微成像技术、晶格光照明技术以及激光扫描显微成像技术(如共聚焦显微镜及双光子显微镜)等。其中激光扫描显微镜利用旋转盘可以进行多焦点的激光扫描,提高时间分辨率,而且有利于减少活细胞成像中的光损伤。本篇文献主要实现了可见光双光子激发及多焦点激光扫描的结合,终提高了3D延时扫描中的空间分辨率及成像对比度,同时这也是可见光双光子激发(v2PE)在超高分辨率显微镜中的应用。双光子显微镜是结合了双光子激发技术和激光扫描共聚显微镜。
为了验证动物生物样品的时间分辨成像能力,本实验观察了活海拉细胞高尔基体中的青色荧光蛋白mTFP1,见图3(a),(c)-(i)。使用的物镜及尺寸与荧光颗粒成像一致,对比可见v2PE在空间分辨率、激发深度级图像对比度较常规宽场显微镜都有所提高。此外,v2PE可以同时激发多个波长的荧光蛋白,这种技术还可以应用于细胞内分子的三维动力学多色成像。在此基础上,实验对海拉细胞中的高尔基体(mTFP1)和纤颤蛋白(EGFP)进行了在体成像,见图3(j)-(n),青色为mTFP1,绿色为EGFP,实验中两种荧光蛋白同时成像,终采用光谱分离法将不同蛋白的荧光信号分离出来。如果已经有了飞秒光,就可以几套双光子显微镜共享一台,只需分光即可。国内2PPLUS双光子显微镜成像视野
双光子显微镜成像技术及不同转基因小鼠开展对多种脏器的成像研究。美国2PPLUS双光子显微镜成像视野
要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本“透明度”提高。高光子密度带来的高能量容易损伤细胞,所以双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,其脉冲达到最大值所持续的周期只有十万亿分之一秒,而其频率可以达到80至100兆赫,这样即能达到双光子激发的高光子密度要求,又能不损伤细胞,使扫描能更好地进行。美国2PPLUS双光子显微镜成像视野