- 品牌
- 司鼎;OriCell
膜片钳操作实验:膜片钳放大器是整个实验系统中的中心,它可用来作单通道或全细胞记录,其工作模式可以是电压钳,也可以是电流钳。从原理来说,膜片钳放大器的探头电路即I-V变换器有两种基本结构形式,即电阻反馈式和电容反馈式,前者是一种典型的结构,后者因用反馈电容取代了反馈电阻,降低了噪声,所以特别适合很低噪声的单通道记录。由于供膜片钳实验的专门计算机硬件及相应的软件程序的相继出现,使得膜片钳实验操作简便、效率提高。如与EPC-9型膜片钳放大器(内含ITC-16数据采集/接口卡)配套使用的软件PULSE/PULSEFIT,它既可产生刺激波形,控制数据采集,又可分析数据,同时具有用于膜电容监测的锁相放大器,多种软件功能集成于一体。科研人员常借细胞膜片钳技术解析离子通道动态响应,帮助评估潜在药物作用。常州细胞生物学离子通道供应商
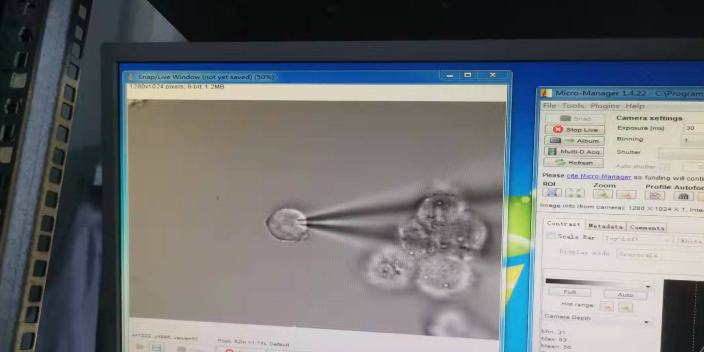
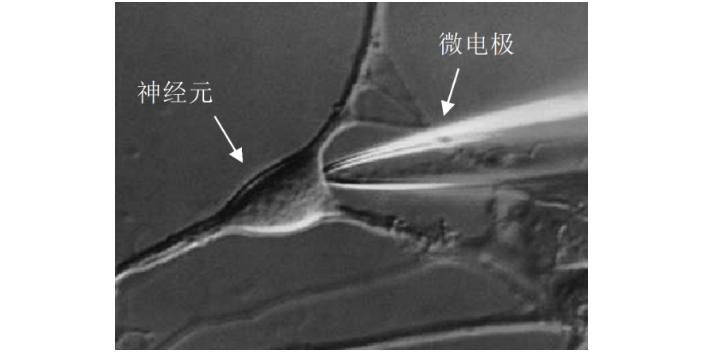
膜片钳技术是用于纪录全细胞或个别细胞膜上离子信道电生理特性的研究方法,目的在于提供基础研究知识与新药开发时研究细胞电特性或小分子药物对细胞膜上离子信道特性的影响,替开发标靶药物提供一个测试平台。传统的细胞培养膜片钳系统由人工操作,实验人员在取得元代细胞(例如心肌细胞与神经元)后,将研究对象细胞养在玻片上,以手动方式将纪录电极移动放置在胞体上方并压到细胞膜上,此时纪录电极在膜外溶液里的电阻大约为3-9 ΜΩ。常州细胞生物学离子通道供应商膜片钳使用的注意事项:打雷天气必须禁止膜片钳实验。
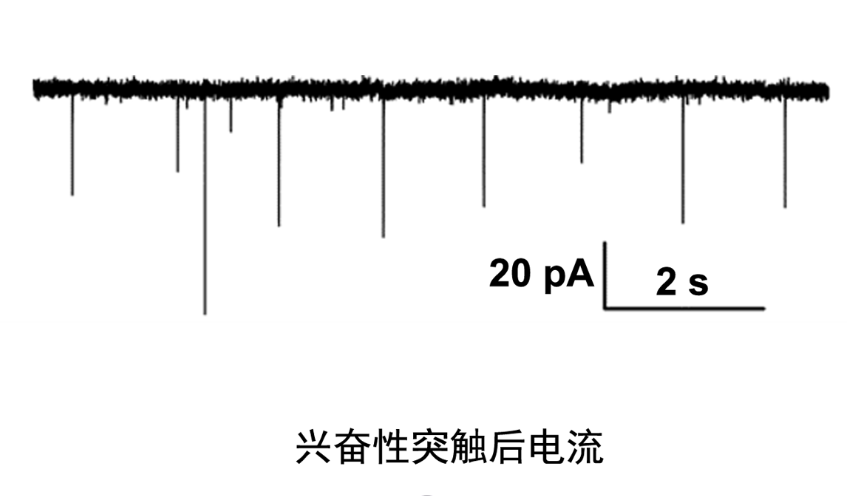
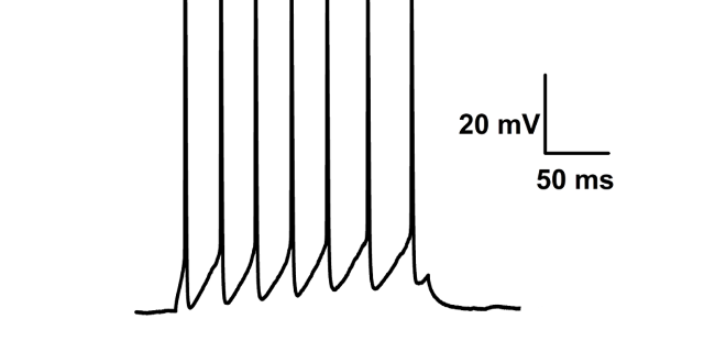
电生理学中的膜片钳技术是一种能够详细揭示细胞膜上离子通道活动的工具,用于分析细胞的电信号变化。通过这项技术,研究人员可以直接测量单个离子通道的电流,观察其开放和关闭的动态过程,从而深入理解离子通道的动力学特性和调控机制。膜片钳不仅限于单个通道的研究,还能调节整个细胞的膜电位,帮助探讨细胞兴奋性的变化。该技术在药物筛选中也发挥着重要作用,能够评估药物对离子通道功能的影响,进而揭示其作用机制。心血管领域利用该技术研究心肌细胞的电活动,为理解心律失常等疾病提供了实验依据。在神经科学中,膜片钳技术帮助解析神经元信号传导和突触传递过程,促进对神经系统功能的认知。通过电生理学膜片钳技术,科学家能够获得细胞级别的精细电信号数据,为基础生命研究和临床应用提供了重要支持。这种技术的多功能性使其成为探索细胞信号转导路径和药理作用机制的不可或缺的实验手段。
膜片钳操作实验:膜片钳实验难度大、技术要求高,要掌握有关技术和方法虽不是很困难的事,但要从一大批的实验数据中,经过处理和分析,得出有意义、有价值的结果和结论,就显得不那么容易,有许多需要注意和考虑的问题,包括减少噪音,避免电极前端的污染,提高封接成功率,具体实验过程中还需要考虑如何选取记录模式,为记录特定离子电流如何选择电极内、外液,如何选择阻断剂、激动剂,如何进行正确的数据采集等许多更为复杂的问题,还需在科研实践中不断地探索和解决。全自动膜片钳系统技术指标:药液交换迅速。细胞内、外液的交换是在平面芯片上进行。
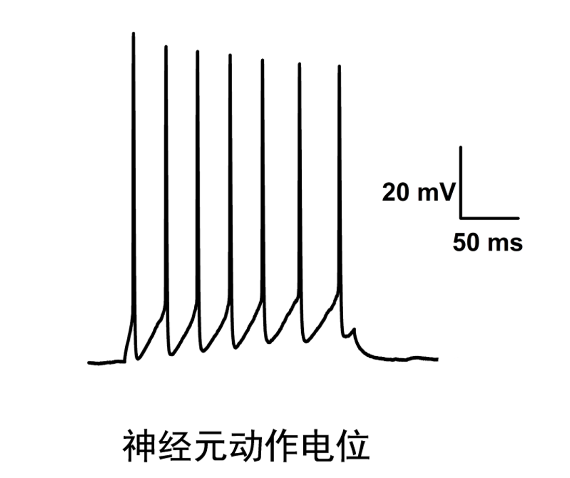
膜片钳使用的注意事项:1.为了防止尘埃、静电伤害机器,每天做实验前请用清水拖地。2.拉制仪使用前需预热15-30min。3.银丝电极及地线发白时,请先用砂纸轻微打磨,再浸入新鲜的次氯酸钠溶液镀氯化银,如果银丝电极30min未变黑,则考虑更换次氯酸钠。4.先开放大器,后开软件;先关软件,后关放大器。5.非必须用到汞灯时请不要打开汞灯电源,打开后至少需1个小时才可关闭。6.在放大器打开时不能用手、金属物品或其它导电的物品接触电极丝(包括地线),在取放细胞片时请关闭放大器。膜片钳技术用特制的玻璃微吸管吸附于细胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜光有少数离子通道。膜片钳使用的注意事项:为了防止尘埃、静电伤害机器,每天做实验前请用清水拖地。在不同科研机构中,膜片钳技术价格通常与实验类型相关,用于匹配测量精度与项目需求。常州细胞生物学离子通道供应商
电生理实验需求,膜片钳技术服务可找上海司鼎生物,助力细胞研究。常州细胞生物学离子通道供应商
膜片钳的数据如何处理:穿孔膜片(perforated patch)是为克服常规全细胞模式的胞质渗漏问题,有学者将与离子亲和的制霉菌素或二性霉素b经微电极灌流到含有类甾醇的细胞膜上,形成只允许一价离子通过的孔,用此法在膜片上做很多导电性孔道,借此对全细胞膜电流进行记录。由于此模式的胞质渗漏极为缓慢,局部串联阻抗较常规全细胞模式高,所以钳制速度很慢,也称为缓慢全细胞模式。它适合于小细胞的电压钳位,对于直径大于30μm的细胞很难实现钳位。不足之处是由于电极与细胞间交换快,细胞内环境很容易破坏,因此记录所用的电极液应与胞浆主要成分相同,如高k+,低na+和ca2+及一定的缓冲成分和能量代谢所需的物质。常州细胞生物学离子通道供应商
在选择膜片钳技术服务商时,科研人员通常关注技术的准确度、服务的专业性以及数据的可靠性。膜片钳技术因其能够详细记录细胞膜离子通道电活动的特点,成为众多科研项目的重要工具。专业的服务商不仅提供设备支持,还能根据实验需求设计个性化的技术方案,协助客户解决实验中的复杂问题。服务过程中,技术团队会确保电极与细胞膜形成稳定的高阻封接,保证数据的准确性和实验的顺利进行。上海司鼎生物科技有限公司作为生命科学领域的技术服务提供者,依托上海科研院所资源,致力于为科研人员提供多方位的膜片钳技术支持。公司结合分子生物学、细胞生物学等多领域的专业背景,打造了涵盖仪器、试剂和技术服务的综合平台,帮助客户实现科研目标,推动...
- 广州细胞生物学膜片钳 2026-01-05
- 嘉兴药理学膜片钳电生理技术原理及步骤 2026-01-04
- 南京神经生物学膜片钳成像方案 2026-01-04
- 南通神经生物学膜片钳实验网站 2026-01-02
- 连云港药理学膜片钳 2026-01-02
- 黄山全自动膜片钳成像原理及步骤 2026-01-01
- 广州医学膜片钳实验原理 2026-01-01
- 厦门医学膜片钳供应商 2025-12-31
- 细胞生物学电生理膜片钳技术 2025-12-31
- 温州神经生物学实用膜片钳哪家好 2025-12-28
- 苏州细胞生物学电生理膜片钳方案 2025-12-25
- 徐州细胞生物学实用膜片钳网站 2025-12-25
- 金华神经生物学膜片钳技术网站 2025-12-24
- 金华全自动脑片膜片钳原理及步骤 2025-12-24
- 合肥细胞生物学膜片钳技术供应商 2025-12-23
- 南通细胞生物学膜片钳全细胞记录供应商 2025-12-22


- 连云港药理学膜片钳 01-02
- 黄山全自动膜片钳成像原理及步骤 01-01
- 广州医学膜片钳实验原理 01-01
- 厦门医学膜片钳供应商 12-31
- 细胞生物学电生理膜片钳技术 12-31
- 温州神经生物学实用膜片钳哪家好 12-28
- 厦门细胞生物学实用膜片钳哪家好 12-27
- 东莞医学脑片膜片钳应用 12-27
- 合肥药理学电生理膜片钳 12-26
- 东莞医学膜片钳技术技术 12-26