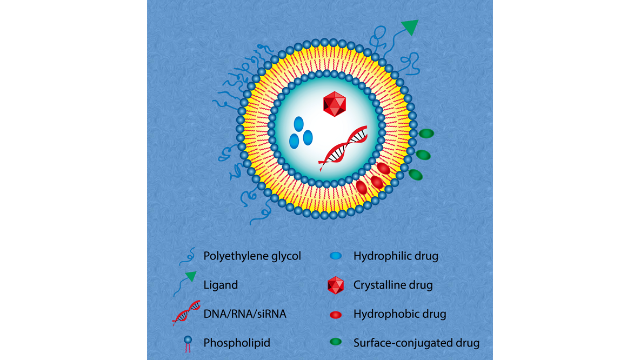
脂质体质量控制的重要性与常规药物剂型(如⼩分⼦注射溶液)不同,脂质体中装载的***性分⼦在全⾝给药后(如静脉注射)转运到肿瘤细胞的过程更为复杂主要经历以下⼏个步骤:(1)从⾎管内间隙外渗到组织间质:脂质体通过扩散和/或对流穿越**⾎管壁不连续的内⽪连接点(100nm-2µm)进⼊**间质。同时⼀部分脂质体被MPS从体循环中***,特别是对于⼤尺⼨(>200nm、疏⽔和带电颗粒表⾯(带负电荷或正电荷)的颗粒。(2)通过扩散和对流进⾏间质运输,以接近单个肿瘤细胞。利⽤主动靶向对脂质体进⾏表⾯修饰将克服颗粒在细胞外基质(ECM)中扩散的物理阻⼒,因为颗粒上的靶向配体与肿瘤细胞表⾯的受体之间产⽣了更⾼的亲和⼒(3)通过⾮特异性或特异性结合的⽅式附着于细胞膜(4)通过内吞作⽤、膜融合或扩散进⼊细胞。内吞作⽤的途径取决于颗粒⼤⼩即⼤⼩为200nm,500nm的颗粒为⽹格蛋⽩介导的内吞作⽤和⼩泡介导的内吞作⽤,⼤胞吞作⽤可达5µm。(5)细胞内转运和药物释放。基于脂质体的这种运输过程由于循环脂质体颗粒⽆法穿过⼼脏⾎管的连续内⽪连接,与传统的阿霉素给药相⽐,Doxil明显降低了⼼脏毒性。与常规药物相⽐DaunoXome可使多柔⽐星的**递送量增加约10倍,并在体内提供持续释放。由于在巨噬细胞上发现了甘露糖受体, 因此甘露糖已被用于修饰阳离子脂质体以靶向巨噬细胞递送。企业脂质体载药蛋白

脂质体制备方法:原位制备脂质体“原位”被认为是临床使⽤前形成的脂质体。Mepacthas的商业化产品就采⽤了这种⽅法进⾏⽣产。将药物和磷脂配制成散装溶液,过滤灭菌、灌装、冻⼲。在Mepacthas中,*包含三种成分,即活性成分胞壁三肽磷脂酰⼄醇胺(MTP-PE)、棕榈酰油酰磷脂酰胆碱(POPC)和⼆酰磷脂酰丝氨酸(OOPS),并按⼀定⽐例(POPC:OOPS=7:3,MTP-PE:磷脂=1:250)。该产品为⼲燥的脂质饼,具有多孔结构,为与体质介质接触提供了较⼤的表⾯积。临床使⽤前,在⼩瓶中加⼊0.9%的⽣理盐⽔溶液,将⼲燥物质⽔化,形成多层脂质体,粒径为2.0-3.5µm,粒径分布为单峰型。磷脂在⽔中的相变温度约为5℃,可以在室温下原位制备脂质体。宁夏脂质体载药试剂质粒DNA要在细胞内被有效地翻译,质粒DNA必须经过有效的细胞内运输进入细胞质,并从细胞质进入细胞核。
脂质体疫苗通常在已知疫苗中使用纯化抗原或减毒病原体作为免疫原。然而,长期的免疫反应可能不会由纯化抗原诱导,甚至有时根本不会诱导反应。另一方面,减毒疫苗可以在免疫的患者中产生应答。然而,递送包裹在脂质体内的抗原可诱导长期应答,这在某些抗原的直接免疫中没有观察到。研究表明,恶性细胞的细胞膜可以形成包封潜在抗原的脂质体。文献报道了包封在脂质体中的肽作为**疫苗的***应用能力。有研究评估了BLP25(一个含有合成人MUC1肽的25个氨基酸序列)作为**疫苗的能力。用二硬脂酰磷脂酰胆碱、胆固醇和二肉豆醇酰磷脂酰甘油(摩尔比3:1:25)中含有的单磷脂酰脂A(1%w/w)制备脂质体,然后与脂偶联和非偶联的MUC1肽结合。C57BL/6小鼠免疫分别采用肽相关脂质体、肽与无肽脂质体混合、脂肽单独免疫。结果表明,脂质体制剂对免疫应答有深远的影响。与物理相关的脂质体观察到强烈的免疫反应(抗原特异性t细胞细胞反应),而与肽混合的无肽脂质体或单独的脂肽则没有。体液免疫反应受到关联性质的***影响,这可以通过表面暴露的肽脂质体诱导muc1特异性抗体来证明。因此可以通过调整脂质体药物传递系统来诱导优先细胞反应这提出了一个假设即不同的脂质体配方刺激不同的免疫途径。
脂质体制备方法:破碎技术尺⼨和尺⼨分布是脂质体性能和安全性的关键属性。有⼏种⽅法可⽤于减少脂质体的尺⼨,如(超)超声(通过浴或探针),挤压,均质,或组合⽅法,如冻融挤压,冻融超声和⾼压均质挤压技术。在这些技术中,挤压和⾼压均质(HPH)是在制药制造中**常⽤的技术。⼤尺⼨的脂质体通过聚碳酸酯膜(50nm~5µm)成为粒径分布精细的较⼩的脂质体。众所周知,商业化的纳⽶脂质体产品,包括Onivyde、Vyxeos、Marqibo等,都是采⽤这种⽅法进⾏⽣产的。该⽅法相对简单,重现性好,只需要适中的条件。尺⼨减⼩的潜在机制是MLV在膜孔⼊⼝处破裂,并在膜通过过程中重新排列。关键的⼯艺参数,如聚碳酸酯膜的孔径、通过循环次数、压⼒和流速等,都可以影响脂质体的⼤⼩和⽚层性。Ong等⼈发现,在⽐较其他不同的纳⽶化技术(包括冻融超声、超声和均质化)时,挤出是***的技术。然⽽,挤压可能会降低脂质体的包封性并改变不对称脂质体的结构。HPH⽤于⽣产各种纳⽶制剂,如脂质体、纳⽶晶体和纳⽶乳液。它既适⽤于⽔体系,也适⽤于⾮⽔体系,并提供不同的⽣产规模,从容量为10L/h的实验室规模到容量为10万L/h的⼤型⽣产规模。中性脂也经常被用作阳离子脂质体的助手,DOPE在胞吞作用后参与内体逃逸。
脂质体的表⾯改性脂质体被⾼度柔性的PEG链包裹形成⽔合层是脂质体修饰的重要⼯具,它可以减少MPS的***,延⻓循环寿命,并防⽌脂质体聚集。另⼀种常⻅的脂质体表⾯修饰是使⽤配体进⾏活性靶向。FDA指南建议纳⽶材料的涂层厚度可以在档案中描述,因为层的覆盖密度和厚度会影响细胞摄取并控制纳⽶颗粒通过⽣物基质的运输。有研究提到,应考虑⾮共价或共价结合的表⾯涂层对产品稳定性、药代动⼒学、⽣物分布、双分⼦相互作⽤和受体介导的细胞相互作⽤的影响。此外,涂层材料应完全表征和控制,包括其⼀致性和可重复性,表⾯覆盖异质性,配体的取向和构象状态,物理化学稳定性,过早脱离,和/或涂层的降解等。一些常用于标记脂质体的荧光染料包括:DiO、DiI、Rhodamine PE、NBD、BODIPY、Cy3和Cy5等。供应脂质体载药DNA
脂质体疫苗可以机器体内的免疫应答。企业脂质体载药蛋白
脂质体配方中脂类的毒性由于LNPs主要由天然脂质组成,它们被认为是无药理活性和毒性**小的。然而,在某些情况下,LNP并非免疫惰性,而LNP成分是可能对人体细胞有毒的非天然化合物。例如,虽然阳离子脂质作为递送脆弱化合物(如核酸)的载体提供了巨大的希望,但一些阳离子脂质会引起细胞毒性。在某些情况下,阳离子脂质会减少细胞中的有丝分裂,在细胞的细胞质中形成液泡,并对关键的细胞蛋白如蛋白激酶c造成有害影响阳离子脂质的细胞毒性取决于它们的结构亲水头基团;具有季铵头基的两亲化合物比具有叔胺头基的两亲化合物毒性更大。疏水链对脂质毒性的影响还没有得到很好的研究,阻碍了低毒性脂质的设计。脂质分子的疏水部分强烈调节其相行为及其对LNP的有用性,但某些脂质相的存在也与膜损伤和细胞毒性有关。PEG-脂质偶联物也可能引起意想不到的毒性,而已知含有PEG-脂质偶联物的LNPs与免疫细胞相互作用,产生针对某些聚乙二醇化脂质的不想要的抗体。企业脂质体载药蛋白