RIP-seq和RIP-qPCR实验都是研究RNA与蛋白质相互作用的实验方法,但存在一些异同点。相同点:两者都基于RNA免疫沉淀(RIP)技术,利用特定蛋白的抗体将RNA-蛋白质复合物沉淀下来,以研究RNA与蛋白质的相互作用。两者都需要对实验条件进行优化,以确保实验的特异性和准确性。不同点:实验目的:RIP-seq主要用于筛选与目标蛋白结合的未知RNA,绘制全基因组范围的RNA与蛋白质相互作用图谱,而RIP-qPCR则用于验证与目标蛋白结合的已知RNA。数据分析:RIP-seq产生高通量测序数据,需要生物信息学分析以识别与蛋白质结合的RNA序列;而RIP-qPCR产生定量PCR数据,通过相对定量方法分析特定RNA与蛋白质的结合情况。应用范围:RIP-seq更适合于发现新的RNA与蛋白质的相互作用,并研究其在全基因组范围内的分布和特征;而RIP-qPCR更适用于特定RNA与蛋白质相互作用的验证和定量研究。总之,RIP-seq和RIP-qPCR实验在研究RNA与蛋白质的相互作用时各有优势,研究者可根据具体需求选择合适的方法。RIP-qPCR实验是一种用于研究细胞内特定蛋白质与RNA相互作用的技术。内蒙古RNA蛋白互作检测RIP Sequence
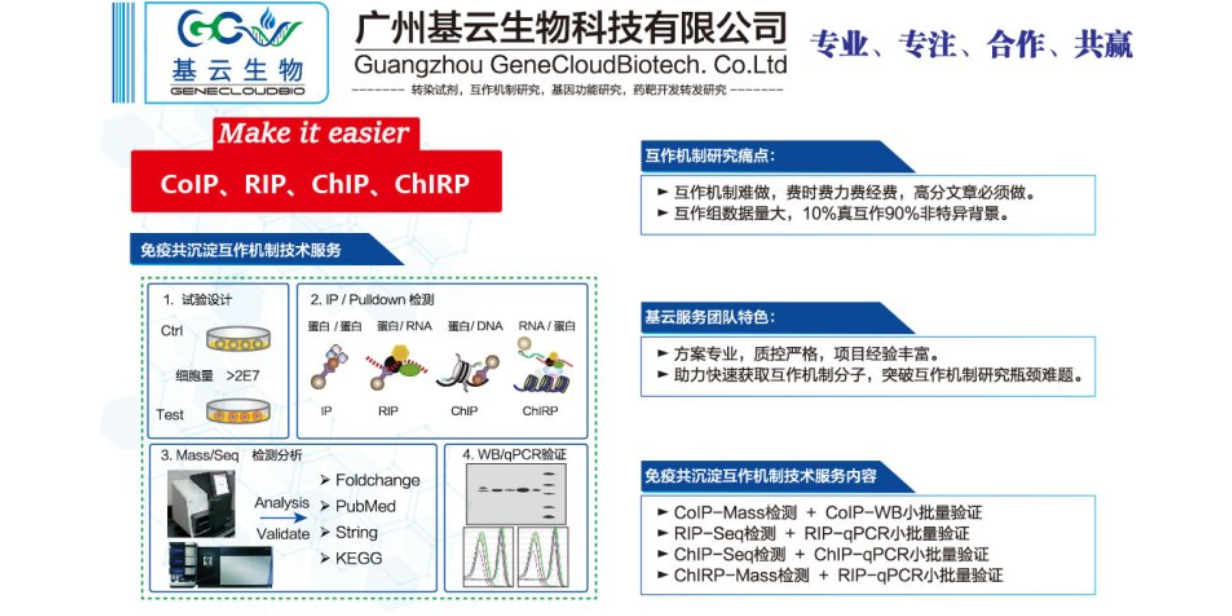
RIP-qPCR实验(RNA Immunoprecipitation followed by quantitative PCR)是一种用于研究细胞内特定蛋白质与RNA相互作用的技术。该技术结合了免疫沉淀(Immunoprecipitation)和实时荧光定量PCR(quantitative PCR,qPCR)的方法,旨在识别和定量与特定蛋白质结合的RNA分子。在RIP-qPCR实验中,首先使用针对目标蛋白质的特异性抗体进行免疫沉淀,将与该抗体结合的蛋白质-RNA复合物从细胞裂解液中分离出来。随后,通过洗涤步骤去除非特异性结合的分子,保留与目标蛋白质特异性结合的RNA。接下来,从免疫沉淀复合物中提取RNA,并将其逆转录为cDNA。然后,利用特异性引物进行qPCR反应,以定量检测与目标蛋白质结合的特定RNA分子的丰度。通过比较不同样品中目标RNA的相对表达水平,可以评估蛋白质与RNA之间的结合强度和特异性。RIP-qPCR实验在生物学研究中具有广泛应用,可用于研究转录后调控、RNA转运、RNA稳定性以及非编码RNA与蛋白质相互作用等方面的问题。该技术为揭示细胞内基因表达调控的复杂网络提供了有力工具。上海RNA免疫沉淀检测RIP-PCR要快速了解RIP实验技术,可以从几个方面入手。
在分子机制研究过程中,RIP-qPCR实验技术扮演着重要角色。该技术主要应用于研究细胞内RNA与蛋白质的相互作用,有助于揭示基因表达的转录后调控机制。通过RIP-qPCR,研究者可以特异性地识别并结合目标RNA结合蛋白(RBP),进而分析与其结合的RNA分子。这一步骤对于理解RBP在细胞内的功能和调控网络至关重要。例如,在疾病研究中,RIP-qPCR可用于检测与疾病相关的RBP及其结合的RNA,从而揭示疾病发生和发展的分子机制。此外,RIP-qPCR还可用于验证生物信息学预测或高通量筛选结果,确认RNA与蛋白质之间的相互作用关系。这对于后续的功能研究和药物研发具有重要意义。总的来说,RIP-qPCR实验技术在分子机制研究中具有广泛的应用场景,特别是在研究RNA与蛋白质的相互作用、揭示转录后调控机制以及疾病相关分子机制等方面。然而,该技术也存在一些局限性,如抗体依赖性、RNA易降解等,因此在实际应用中需要谨慎选择和优化实验条件。尽管如此,随着技术的不断发展,RIP-qPCR仍将是分子机制研究领域的有力工具之一。
做好RIP-qPCR实验,应该注意以下几个关键问题。首先,实验设计至关重要。明确实验目的,选择合适的对照组,如使用非特异性抗体作为阴性对照,确保结果的准确性。同时,对实验条件进行优化,包括抗体浓度、反应时间等,以获得较好的实验效果。其次,样本处理需格外小心。在收集和处理样本时,要防止RNA降解,使用无RNase的试剂和耗材,并尽可能在低温下进行操作。此外,样本的均一性和代表性也是实验成功的关键。再者,引物设计不容忽视。引物应具有高特异性和适当的退火温度,以避免非特异性扩增和引物二聚体的形成。同时,引物应跨越内含子或位于不同外显子上,以排除基因组DNA的污染。此外,实验操作要规范。严格遵守RNA操作规范,避免RNA酶的污染。在加样、PCR反应等步骤中,要确保准确性和可重复性另外,数据分析要科学。使用适当的统计方法分析实验数据,确保结果的可靠性和有效性。同时,对异常值或不符合预期的结果进行深入分析,找出可能的原因。总之,做好RIP-qPCR实验需要注意实验设计、样本处理、引物设计、实验操作和数据分析等方面的问题。只有充分考虑并处理好这些问题,才能获得准确、可靠的实验结果。RIP实验是一种强大的技术,用于研究细胞内RNA与蛋白质的相互作用。

进行RIP-qPCR实验,应该注意以下几个关键问题,以确保实验的成功和准确性。1. 样本处理:确保样本新鲜且未受污染,避免RNA降解。在处理过程中使用无RNase的试剂和耗材,并在冰上操作以维持低温环境。2. 抗体选择:选择特异性强的抗体进行免疫沉淀,这是实验成功的关键。验证抗体的特异性和效力,以确保准确捕捉目标RNA-蛋白质复合物。3. 引物设计:设计特异性针对目标RNA的引物,避免非特异性扩增。确保引物的质量和纯度,以获得可靠的qPCR结果。4. 实验对照:设置适当的对照实验,如使用非特异性抗体作为阴性对照,以验证实验结果的特异性和准确性。5. 操作规范:严格遵守RNA操作规范,避免RNA酶的污染。确保实验环境的清洁和无菌,以减少误差和干扰。6. 数据分析:使用适当的统计方法和软件分析实验数据,确保结果的准确性和可靠性。注意识别并排除异常值,以获得真实可信的结果。综上所述,进行RIP-qPCR实验时,你应注意样本处理、抗体选择、引物设计、实验对照、操作规范和数据分析等关键问题。通过仔细考虑和遵循这些注意事项,可以提高实验的成功率和准确性。对于科研新手来说,在进行RIP-qPCR实验时,需要特别注意哪些问题。RNA蛋白相互作用检测RIP联合测序
RIP-qPCR实验技术有哪些应用场景。内蒙古RNA蛋白互作检测RIP Sequence
RNA结合蛋白-RNA复合物的免疫沉淀(RIP)免疫沉淀方法:
1.制备RIP免疫共沉淀缓冲液。每次免疫沉淀需要900μL的RIP免疫沉淀缓冲液。每个反应在860µL的RIP洗涤缓冲液中加入35μL的0.5MEDTA和5µL的RNase抑制剂。
2.将第二节第10步中的试管放在磁性分离器上,并丢弃上清液。在每根试管中加入900µL的RIP免疫共沉淀缓冲液。3.快速解冻RIP裂解液,在4℃下以14000rpm离心10分钟。取出100µL的上清液,加入RIP免疫沉淀缓冲液中的每个磁珠-抗体复合物。免疫共沉淀反应的ZUI终体积将为1.0mL。
4.取出10µL的RIP裂解液上清液,并将其放入一个新的试管中,并贴上“input”的标签。将该样本存储在-80°C,直到开始RNA纯化(第四节)。这表示“10%的input”,将用于生成标准曲线或用于RT-PCR方法的比较(实时或终点)。
5.取出10µL的RIP裂解液上清液,通过蛋白印迹法检测目标RNAbinding蛋白的表达。将10µL的2XSDS-PAGEloading缓冲液加入到10µL的RIP裂解液中,然后在95°C下加热。RIP裂解液可直接应用于SDS-PAGE。
......
广州基云生物,在IP互作组检测和关键机制分子筛选验证领域,具有丰富的经验,助力您的互作机制研究。 内蒙古RNA蛋白互作检测RIP Sequence